Контрольная работа: Ненасыщенные альдегиды и кетоны
Ненасыщенные альдегиды и кетоны
Ненасыщенные альдегиды и кетоны, в зависимости от взаимного расположения двойной и карбонильной групп в молекуле, могут быть поделены на три группы: с сопряженными (CH=CH2 -COCH3 — метилвинилкетон, бутен-1-3-он; CH2 =CHCHO — акролеин, пропеналь), кумулированными (кетены CH2 =C=O) и изолированными (CH2 =CHCH2 CH2 CH2 COCH3 ) связями. Из них наибольший интерес представляют соединения с сопряженными связями, особенно — акролеин и кротоновый альдегид
Для некоторых ненасыщенных альдегидов и кетонов сохранились эмпирические (акролеин) или рациональные (метилвинилкетон) названия. По номенклатуре IUPAC положение двойной связи и карбонильной группы указывают цифрами.
Важнейшими представителями ненасыщенных альдегидов являются акролеин CH2 =CH-CHO и кротоновый альдегид CH3 -CH=CH-CHO.
Существует несколько способов получения акролеина:
1. Альдольная конденсация формальдегида с ацетальдегидом
CH2 =O + CH3 -CHO ® CH2 OH-CH2 -CHO
оксипропионовый альдегид
Оксипропионовый альдегид далее подвергается дегидратации:
CH2 OH-CH2 -CHO ® CH2 =CH-CHO + H2 O
2. Прямое каталитическое окисление пропилена
CH2 =CH-CH3 + O2 ® CH2 =CH-CHO + H2 O
3. Дегидратация глицерина
CH2 OH-CHOH-CH2 OH ® CH2 OH-CH=CHOH « CH2 OH-CH2 -CH=O ® CH2 =CH-CHO
Акролеин используется для получения пластмасс, отличающихся большой твердостью. При конденсации акролеина с пентаэритритом получают полимеры, по внешнему виду напоминающие стекло. Акролеин используют в качестве исходного вещества для синтеза глицерина.
Кротоновый альдегид получают кротоновой конденсацией ацетальдегида (см. Лекция №24). Применяется для получения масляного альдегида, бутанола, масляной кислоты, а также малеинового ангидрида.
Химические свойства
Акролеину, кротоновому альдегиду и другим непредельным соединениям с сопряженной двойной и карбонильными связями присущи реакции, свойственные алкенам и альдегидам. Взаимное влияние двойной связи и карбонильной группы находит отражение в некоторых особенностях, например:
1. Порядок присоединения HBr не соответствует правилу Марковникова
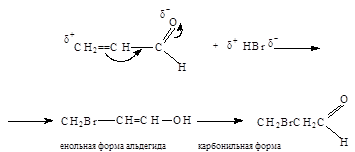
2. Синильная кислота присоединяется к акролеину по карбонильной группе:
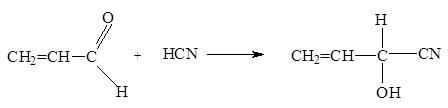
3. Гидросульфит натрия присоединяется не только по карбонильной группе, но и по двойной связи:
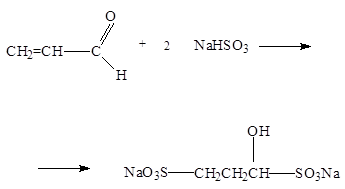
Метилвинилкетон — простейший представитель ненасыщенных кетонов. Существует в виде двух изомеров:
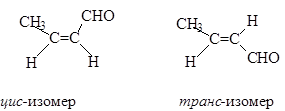
Метилвинилкетон получают преимущественно двумя способами:
1. Гидратация винилацетилена.
HCºC-CH=CH2 + H2 O ® CH3 COCH=CH2
2. Конденсация формальдегида с ацетоном:
H2 C=O + CH3 COCH3 ® HOCH2 CH2 COCH3 ® CH2 =CHCOCH3
Метилвинилкетон проявляет свойства как кетона, так и алкенов. Легко полимеризуется в прозрачную бесцветную стекловидную массу, используемую в производстве пластмасс.
Кетенами называются соединения, содержащие группу >C=C=O. По строению они напоминают непредельные кетоны. Простейший кетен CH2 =C=O может быть получен из бромангидрида бромуксусной кислоты под действием цинковой пыли:
CH2 BrCOBr + Zn ® CH2 =C=O + ZnBr2
В промышленности кетен получают пиролизом ацетона
CH3 COCH3 ® CH2 =C=O + CH4
и дегидратацией уксусной кислоты в присутствии катализаторов кислотного типа:
CH3 COOH ® CH2 =C=O + H2 O
CH3 COOH + H+ ® CH3COO+ H2 ® CH3 C+ =O ® CH2 =C=O + H+
Кетены чрезвычайно легко реагируют с водой:
CH2 =C=O + H2 O ® CH3 COOH
карбоновыми кислотами:
CH2 =C=O + CH3 COOH ® (CH3 CO)2 O.
Спиртами:
CH2 =C=O + CH3 CH2 OH ® CH3 COOCH2 CH3 .
Аминами:
CH2 =C=O + CH3 NH2 ® CH3 CONHCH3 + H2 O.
В промышленности из кетена получают уксусную кислоту, уксусный ангидрид, этилацетат, дикетен и другие вещества, являющиеся полупродуктами в производстве красителей и лекарственных веществ.
Кетен легко полимеризуется с образованием дикетена:
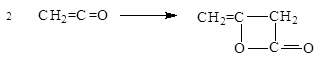 .
.
Дикетен реагирует с водой, спиртами, аминами:
CH2 =COCH2 CO + H2 O ® CH3 COCH2 COOH.
Ароматические альдегиды и кетоны
Ароматические альдегиды и кетоны характеризуются наличием карбонильной группы, связанной с углеродом бензольного ядра или боковой цепи. Альдегиды с карбонильной группой первого типа называются по соответствующим ароматическим кислотам, а с карбонильной группой в боковой цепи – как арилзамещенные альдегиды жирного ряда.
Кетоны бывают чисто ароматические (дифенилкетон или бензофенон) и жирноароматическими (метилфенилкетон или ацетофенон).
Способы получения ароматических альдегидов
Многие ароматические альдегиды могут быть получены способам, описанными для альдегидов жирного ряда (Лекция№23): окисление первичных спиртов, сухая перегонка кальциевых солей ароматической и муравьиной кислот, синтезы с участием реактивов Гриньяра и др.
1. Окисление ароматических углеводородов.
Важный способ синтеза ароматических альдегидов (в частности, бензальдегида) – окисление углеводородов кислородом воздуха на катализаторе (V2 O5, MnO2 ):
C6 H5 -CH3 ® C6 H5 -CHO
Способ имеет как лабораторное, так и промышленное значение.
2. Формилирование ароматических углеводородов.
Для ароматического ряда известны реакции прямого введения альдегидной группы, не имеющие аналогий в жирном ряду (реакция Гаттермана-Коха):
C6 H5 CH3 + HCl+CO ® CH3 -C6 H4 -CHO
Реакция катализируется хлоридами меди и алюминия. Предполагается, что в качестве промежуточного продукта образуется хлористый формил HCOCl, не существующий в свободном виде. Бензол в эту реакцию вступает очень плохо, его гомологи дают хорошие выходы (50-60%).
3. Гидролиз гем-дигалогенпроизводных.
Существует способ получения бензальдегида через хлористый бензилиден C6 H5 CHCl2 :
C6 H5 CH3 + Cl2 ® C6 H5 CHCl2 + H2 O ® C6 H5 CHO + 2 HCl
толуол хлористый бензилиден бензальдегид
Гидролиз проводится в присутствии катализатора (Fe).
Способы получения ароматических кетонов
Для получения ароматических кетонов применимы многие методы получения кетонов жирного ряда (окисление вторичных спиртов, перегонка кальциевых солей ароматической и какой-либо другой кислоты, кроме муравьиной — см. Лекцию №23).
Реакция Фриделя-Крафтса. В качестве исходных веществ могут использоваться ароматические углеводороды, эфиры фенолов:
C6 H6 + Cl-CO-C6 H5 ® C6 H5 -CO-C6 H5 + HCl
хлористый бензоил бензофенон
Реакция катализируется хлористым алюминием.
Химические свойства ароматических альдегидов
Ароматические альдегиды вступают в большинство реакций, свойственных альдегидам жирного ряда. Специфическими реакциями ароматических альдегидов являются следующие:
1. Реакция Канниццаро.
В присутствии водного или спиртового раствора щелочи (50%) ароматические альдегиды могут диспропорционировать, образуя соответствующий спирт и соль кислоты (реакция Канниццаро):
2 C6 H5 CHO + KOH ® C6 H5 COOK + C6 H5 CH2 OH
бензальдегид бензоат калия бензиловый спирт
Большинство альдегидов жирного ряда в условиях реакции Канниццаро подвергаются осмолению, однако, если в альдегиде отсутствует атом водорода в a-положении, то реакция протекает вполне гладко. Механизм реакции следующий:
2. Бензоиновая конденсация. Под действием цианид-иона две молекулы ароматического альдегида могут конденсироваться с образованием a-оксикетона. Поскольку простейшее соединение, образующееся при конденсации бензальдегида, называется бензоином, эта последовательность реакций получила название бензоиновой конденсации:
Реакционная способность ароматических альдегидов и кетонов зависит от заместителей в ароматическом ядре. Так, наличие электроноакцепторных групп (NO2 -) повышает реакционную способность по карбонильной группе. Большое значение имеет также пространственный фактор: заместитель (трет-С4 H9 -, SO3 H-) в орто-положении ароматического ядра снижает реакционную способность.
Большинство ароматических кетонов реагируют с гидроксиламином и производными гидразина по обычной схеме:
(Ar)2 C=O + NH2 OH ® (Ar)2 C=NOH + H2 O
кетоксим
(Ar)2 C=O + NH2 -NH-C6 H5 ® (Ar)2 C=N-NH-C6 H5 + H2 O
фенилгидразон
Из всех азотистых производных кетонов наибольший интерес представляют оксимы. Оксимы чисто ароматических несимметричных кетонов существуют в виде двух геометрических изомерных форм, син- и анти-:
Из всех азотистых производных кетонов наибольший интерес представляют оксимы. Оксимы чисто ароматических несимметричных кетонов существуют в виде двух геометрических изомерных форм, син- и анти-. Син-формой принято считать изомер, содержащий меньший радикал в цис-положении с гидроксильной группой оксима. Более стойкой является анти-форма. Она получается из син-формы под действием кислот. Аналогичное явление известно и для оксимов ароматических альдегидов:
Оксимы жирноароматических кетонов обычно существуют в виде одной более стойкой формы. Важным свойством оксимов является их способность подвергаться перегруппировке Бекмана: под действием ангидридов и хлорангидридов кислот два изомерных оксима дают два изомерных амида:

перегруппировка Бекмана используется для получения w- и e-аминокислот.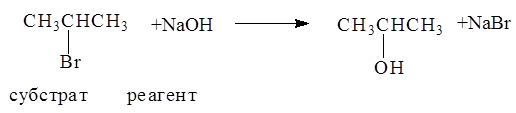
Реакция замещения галогена на ОН-группу протекает по механизму нуклеофильного замещения SN. В зависимости от строения субстрата замещение протекает по SN1 (мономолекулярное замещение):
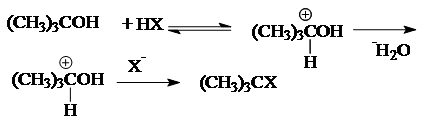
или SN2 (бимолекулярное):
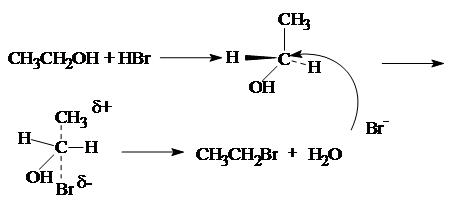
Атакующий агент – анионы (SH -, OН -, I -, Br -, С l -, F -, RO -, CH3 COO -, ONO2- ) или молекула (ROH, HOH, NH3, RNH2 ). По увеличению реакционной способности анионы располагаются в следующий ряд:
HS -, RS - > I - > Br — > RO — > Cl — > CH3 COO — > ONO2-
Анионы более сильные нуклеофилы, чем сопряженные кислоты:
OH — > HOH, RS — > RSH, RO — > ROH, Cl — >HCl
Нуклеофил – атом (или частица), который может отдать пару электронов любому элементу, кроме водорода. Механизм бимолекулярного нуклеофильного замещения (SN2 ) включает образование промежуточного комплекса.
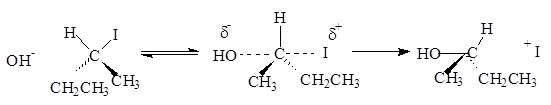
Представленная реакция является реакцией замещения, так как нуклеофил (ОН - ) вытесняет уходящую группу (I- ).
Механизм мономолекулярного нуклеофильного замещения (SN1 ) состоит из двух стадий:
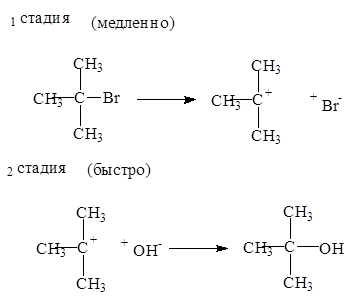
Реакции замещения по механизму SN1 в тех случаях, когда образуется стабильный катион. Первичные галогеналканы реагируют по механизму SN2, а третичные — по механизму SN1.